使用 MegAlign Pro 进行准确的序列比对和深入分析。
众所周知,市面上有许多多序列对齐工具,但初始序列对齐只能让您走到这一步。正是对齐后分析真正推动了您回答研究问题的道路。MegAlign Pro 为多序列比对的每个阶段提供所需的一切,不仅提供比对基因水平和基因组规模序列数据所需的算法,而且还提供在比对后阶段深入挖掘的能力。
MegAlign Pro 可指导您完成比对后过程,包括生成和比较多个系统发育树,以及识别和分析基因组菌株中的变异。您可以轻松地为新的子比对分离感兴趣的区域,编辑和修剪单个序列或整个比对,并在生成适合发布的高质量图像之前自定义比对外观。
序列比对软件功能
- 使用 Clustal Omega、Clustal W、MAFFT、MUSCLE 和 Mauve 多序列比对方法比对 DNA、RNA 或蛋白质序列。
- 利用自动指导,根据数量、长度和类型为您的特定序列选择比对方法。
- 识别和评估病毒、线粒体或叶绿体基因组之间的变异。
- 轻松修剪路线起点或终点的端点。
- 使用不同的参数或不同的比对方法重新比对一系列比对序列。
- 通过将两个现有的已完成路线合并在一起来创建纵断面路线。
- 使用 RAxML(用于计算机最大似然树)或 Neighbor Joining 方法生成、自定义和比较多个系统发育树。
通过 4 个简单的步骤进行多序列比对

第 1 步
使用所需方法对齐序列

第2步
评估变体
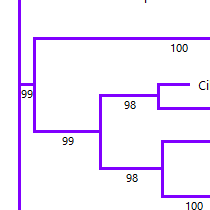
第3步
生成和比较系统发育树

第4步
自定义外观和导出以供发布

了解有关我们的多序列比对软件的更多信息
资源
有关我们的序列比对软件 MegAlign Pro 的更多信息,请参阅以下资源。
教程
观看我们的视频或查看我们的书面教程,了解有关使用我们的序列比对软件 MegAlign Pro 的更多信息。
使用 Mauve 比对基因组
MegAlign Pro 允许您使用 Mauve 算法进行多个基因组比对。比对后,创建系统发育树并探索序列轨迹以进行下游分析。

在 MegAlign Pro 中合并和重新对齐序列
在此视频中,了解如何执行纵断面路线以将两条路线合并在一起。此外,了解如何合并和重新对齐 MegAlign Pro 项目中的其他序列。
对齐多段文件
在本视频中,了解如何在 MegAlign Pro 中处理多片段文件。多片段文件是由多个染色体、重叠群或片段组成的文件,在进行多个序列比对之前必须首尾对齐。


在 MegAlign Pro 中添加用于对齐的序列文件
了解如何将不同的核苷酸和蛋白质序列加载到 MegAlign Pro 中,以进行多序列和成对序列比对和系统发育树。此视频将引导您了解在执行比对之前添加和组织序列数据的不同方法。
常见问题
如何创建多序列比对?
在 MegAlign Pro 中执行多序列比对非常简单。
- 从 Welcome (欢迎) 屏幕中,选择 New Alignment (新建对齐)。
- 选择要对齐的序列。
MegAlign Pro 将使用确定最适合您数据的对齐方法和参数执行对齐。
或者
- 从 Welcome (欢迎) 屏幕中,选择 New Alignment with options (新建对齐方式选项)。
- 选择要对齐的序列。
- 指定对齐算法,根据需要更改其他设置,然后单击 Align 开始对齐。
显示简要信息
DNA 和蛋白质有哪些多序列比对方法?
MegAlign Pro 包括 Clustal Omega、Clustal W、MAFFT 和 MUSCLE 多序列比对方法。
我可以使用 MegAlign Pro 比对我的 ABI/示踪文件或其他测序读长吗?
简短的回答是,您不应该使用 MegAlign Pro 来对齐 ABI/trace 或其他原始读取文件,而应该使用 SeqMan Ultra 或 SeqMan NGen 来组装读取。
术语 sequence alignment 和 sequence assembly 的含义非常不同,但通常可以互换使用。这可能会给许多研究人员带来困惑。下面,我们定义了每个术语以及用于该工作流程的 Lasergene 应用程序。
MegAlign Pro 是一款序列比对软件。这种类型的软件用于检查两个或多个生物体或菌株之间的序列相似性或进化相关性。您可能想要对齐的序列示例包括 a) 来自同一病毒的不同菌株的序列,目的是了解病毒如何随时间变化,以及 b) 来自不同植物和动物物种的组蛋白基因序列,目的是创建一个系统发育树来显示它们的进化关系。
用于序列比对的常见序列类型是 .fasta 和 .genbank。
一些多序列比对软件应用程序(包括 MegAlign Pro)允许您指定要在比对中使用的参考序列。在这种情况下,引用被视为其他序列将与之进行比较的“标准”序列。其他序列中的残基可以着色/显示/隐藏,以直观地显示哪些残基与每个位置的参考匹配(或不匹配)。
相比之下,序列组装软件用于从单个 DNA 样本的短片段创建更长的共有序列,通常称为“测序读长”或简称为“读长”。
用于序列组装的常见序列类型包括 .fasta、.fas、.fastq 和 .abi。在 Lasergene 中,SeqMan Ultra 用于组装 .abi 跟踪数据文件,而 SeqMan NGen 用于组装所有其他文件类型,包括使用 Illumina、PacBio 和 Oxford Nanopore (ONT) 测序技术生成的序列。MegAlign Pro 不用于任何类型的序列组装。
与序列对齐一样,也可以在序列组合中指定参考序列。但在这种情况下,参考被用作模板或支架,允许 DNA 片段比从头组装更快、更准确地组装成更大的重叠群。
显示简要信息
是否有多基因组比对方法?
是的。MegAlign Pro 的 Mauve 算法具有高容量,并使用 MUSCLE 对微生物基因组进行块比对。该算法是在威斯康星大学麦迪逊分校的基因组进化实验室开发的。
我的基因组比对中的变异有哪些信息可用?
执行组装后,MegAlign Pro 可以计算其他序列与当前指定的参考序列之间或所有序列与一致性之间的变体。
有关对齐中变体的详细信息,包括位置、特征、影响和翻译更改,可以在 Variants 表中进行评估,您可以通过单击 Variants 选项卡或选择 View > Variants > Show 来访问该表。
什么是纵断面对齐?
Profile 比对会合并两个现有的多序列比对,而不会删除任何现有间隙。但是,可能会自动插入新的间距以协调新路线。
MegAlign Pro 提供哪些方法计算系统发育?
MegAlign Pro 提供了两种生成系统发育树的方法:RAxML(用于计算机最大似然树)和邻域连接方法(使用 BIONJ 算法)。
MegAlign Pro 是否支持在单个项目中创建多个系统发育树?
是的。MegAlign Pro 可以轻松地为单个比对设置多个树,因此您可以使用不同的系统发育方法或对比对的更改轻松进行比较。
如何导出多序列比对的图像?
选择“文件”>“导出图像>(视图名称)”,然后选择导出格式:Adobe PDF (.pdf)、Microsoft PowerPoint 优化 (.pptx)、PNG 图像 (.png) 或 JPG 图像 (.jpg、.jpeg)。
我可以修改我的多序列比对吗?
Lasergene 的序列比对软件 MegAlign Pro 支持多种方式修改比对。您可以:
- “修剪”在路线的起点或终点处结束。
- 使用不同的参数或不同的对齐引擎重新对齐一系列对齐序列。
- 将两条现有的已完成路线合并在一起。
- 将 “Unaligned Sequences” 区域中的所有/选定序列添加到当前比对中,同时保留原始合并前比对的所有间隙。
- 重新对齐现有对齐序列加上选定的未对齐序列
我可以修改多序列比对中的单个序列吗?
是的。MegAlign Pro 使您能够对比对中的单个序列进行反向补码、编辑和修整。
为我的共有序列查找序列匹配的最简单方法是什么?
MegAlign Pro 的搜索向导(使用搜索>序列搜索访问)允许您针对 NCBI 的 BLAST 数据库之一搜索查询序列。序列可以是活动序列的一部分或全部、计算机上的另一个序列文件或键入/粘贴的文本。
我可以将带注释的源序列中的特征映射到密切相关的序列吗?
MegAlign Pro 的特征映射(特征>映射特征)命令允许您将源序列中的单个注释或所有注释映射到目标序列。所涉及的序列必须事先对齐。在此过程中,您可以选择过滤注释以包含/排除特定基因类型。特征映射最常用于将所需的注释从 “完全注释” 序列映射到密切相关但 “未完全注释” 的序列。
显示简要信息
我可以使用多段序列进行 MUSCLE 对齐吗?
由多个染色体、重叠群或片段组成的序列称为多段序列。当您使用 File > Add Sequences End-to-end 命令而不是标准的 File > Add Sequences 命令将一组序列输入到 MegAlign Pro 中时,整个数据集将端到端连接并被视为单个多片段序列。
将间隙序列添加到我的多序列比对项目中的最佳方法是什么?
要从现有 MegAlign Pro 文件导入间隙序列,请使用 File > Open 并选择 .msa 文件。打开项目后,选择所有序列,然后使用 Align > Unalign Selected。
要从其他类型的文件中导入有间隙的核苷酸序列,请使用 SeqMan Pro 去除间隙。启动 SeqMan Pro,然后将间隙序列文件拖放到 SeqMan Pro 窗口。选择所有序列,然后选择 Contig > Export Sequences > Single File。选择 FastA 或 GenBank Flat File 格式,然后选择文件名和位置。确保 Include gaps (包括间隙) 未选中,然后单击 Save (保存)。现在,可以像往常一样将新保存文件中的序列添加到 MegAlign Pro 中。
我应该使用哪种多序列比对方法?
对于蛋白质或核苷酸序列的基因水平比对,请使用 Clustal Omega、Clustal W 或 MAFFT。它们为速度、容量、算法等提供了可编辑的选项,并且是唯一可用于 “profile” 对齐的方法。基因水平对准器的缺点是序列必须在同一链上,并且不允许大重排(例如,倒位、易位)。对于核苷酸序列的基因组水平比对,请使用 Mauve。Mauve 具有很高的容量,并使用 MUSCLE 为每个包含多个序列的区组创建多个比对。
引用
Natural transformation allows transfer of SCCmec-mediated methicillin resistance in Staphylococcus aureus biofilms
Maree, M., Thi Nguyen, L.T., Ohniwa, R.L. et al. (2022). Nat Commun 13, 2477. https://doi.org/10.1038/s41467-022-29877-2.
SARS-CoV-2 spike gene Sanger sequencing methodology to identify variants of concern
Alhamlan FS, Bakheet DM, Bohol MF et al. (2023). Future Science Biotechniques, Vol. 74, No. 2. https://doi.org/10.2144/btn-2021-0114.
Molecular epidemiological survey of porcine epidemic diarrhea in some areas of Shandong and genetic evolutionary analysis of S gene
Shen Y, Yang Y, Zhao J, Geng N, Liu K, Zhao Y, Wang F, Liu S, Li N, Meng F and Liu M (2022). Front. Vet. Sci. 9:1015717. https://doi.org/10.3389/fvets.2022.1015717.
Genetic modification regulates pathogenicity of a fowl adenovirus 4 strain after cell line adaptation (genetic mutation in FAdV-4 lowered pathogenicity)
Yeo J, Lee R et al. (2023). Heliyon Open Access, Vol. 9, Issue 9, E19860, September 2023. https://doi.org/10.1016/j.heliyon.2023.e19860
Prevalence of foodborne viruses and influenza A virus from poultry processing plants to retailed chickens
Yeo D, Song M, Hossain MI, Jung S, Wang Z, Seo DJ, Rhee MS and Choi C (2023). Front. Sustain. Food Syst. 7:1113743. https://doi.org/10.3389/fsufs.2023.1113743.
Anti-tick vaccine candidate subolesin is important for blood feeding and innate immune gene expression in soft ticks
Nandy K, Tamakloe C, Sonenshine DE, Sultana H, Neelakanta G (2023). PLoS Negl Trop Dis 17(11): e0011719. https://doi.org/10.1371/journal.pntd.0011719
Flowering time regulation by the miRNA156 in the beet (Beta vulgaris ssp. maritima)
Asgari, M., Mirzaie-asl, A., Abdollahi, M.R. et al. (2022). Plant Cell Tiss Organ Cult 150, 361–370. https://doi.org/10.1007/s11240-022-02285-6.
Functional aspects of evolution in a cluster of salivary protein genes from mosquitoes
Patricia H. Alvarenga, Denis R. Dias, Xueqing Xu, Ivo M.B. Francischetti, Apostolos G. Gittis, Gabriela Arp, David N. Garboczi, José M.C. Ribeiro, John F. Andersen (2022), Insect Biochemistry and Molecular Biology, Volume 146, 2022, 103785, ISSN 0965-1748, https://doi.org/10.1016/j.ibmb.2022.103785.
A novel genotype of avian hepatitis E virus identified in chickens and common pheasants (Phasianus colchicus), extending its host range
Matos, M., Bilic, I., Tvarogová, J. et al. (2022). Sci Rep 12, 21743. https://doi.org/10.1038/s41598-022-26103-3.
Whole genome sequencing and taxonomic profiling of two Pantoea sp. isolated from environmental samples in Israel
Guedj-Dana, Y., Cohen-Gihon, I., Israeli, O. et al. (2022). BMC Genom Data 23, 31. https://doi.org/10.1186/s12863-022-01049-7.

